從腦組織和生物液體中分離出來的EV可作為未來神經(jīng)相關(guān)疾病診斷、預(yù)后和治療發(fā)展的可靠資源
發(fā)布時間:
2022-02-10
來源:
作者:
閱讀數(shù):
阿爾茨海默病(AD)是一種廣泛性神經(jīng)退行性腦疾病,與其他類型的癡呆癥一起,它影響著全球約4400萬人。近年來,細(xì)胞外囊泡(EV)在生理和病理條件下的細(xì)胞間通訊中發(fā)揮著重要作用,引起了研究者的廣泛關(guān)注。
越來越多的證據(jù)表明,從腦組織和生物液體中分離出來的EV會被包括AD在內(nèi)的神經(jīng)退行性疾病動態(tài)地改變,并反映出一種特定疾病的分子特征。因此,EV可以作為未來神經(jīng)相關(guān)疾病診斷、預(yù)后和治療發(fā)展的可靠資源。

近日,波士頓大學(xué)醫(yī)學(xué)院科學(xué)家在J Extracell Vesicl雜志上發(fā)表了題為“Human neural cell type-specific extracellular vesicle proteomedefines disease-related molecules associated with activated astrocytes in Alzheimer’s disease brain”的文章。作者研究了從四種不同的人類誘導(dǎo)多能干細(xì)胞來源的神經(jīng)細(xì)胞(興奮性神經(jīng)元、星形膠質(zhì)細(xì)胞、小膠質(zhì)樣細(xì)胞和少突膠質(zhì)樣細(xì)胞)中分離出的細(xì)胞外囊泡(EV)的蛋白質(zhì)組學(xué)特征。
在本研究中作者發(fā)現(xiàn)興奮性神經(jīng)元(ATP1A3,NCAM1)、星形膠質(zhì)細(xì)胞(LRP1,ITGA6)、小膠質(zhì)細(xì)胞樣細(xì)胞(ITGAM,LCP1)和少突膠質(zhì)細(xì)胞樣細(xì)胞(LAMP2,F(xiàn)TH1)以及16個泛EV標(biāo)記候選細(xì)胞(包括整合素和膜聯(lián)蛋白)的新的細(xì)胞類型特異性EV蛋白標(biāo)記物。
在這里,作者分離了培養(yǎng)的興奮性神經(jīng)元、星形膠質(zhì)細(xì)胞、小膠質(zhì)細(xì)胞樣細(xì)胞和來自人類誘導(dǎo)多能干細(xì)胞(hipsCs)的少突膠質(zhì)細(xì)胞分泌的EV。作者還使用無標(biāo)記質(zhì)譜(MS)分析了EV樣品,并鑒定了所有EV樣品共有的16個共同蛋白質(zhì),這將有助于從人類腦組織中分離EV。
此外,作者的數(shù)據(jù)揭示了不同腦細(xì)胞衍生的EV中不同的蛋白質(zhì)譜,這些蛋白譜反映了每種細(xì)胞類型的獨特EV裝載量,為細(xì)胞類型特異性EV生物標(biāo)志物的發(fā)現(xiàn)提供了全面而公正的信息。
為了證明這些EV蛋白特征的有效性,作者分析了30個從健康對照組(HC)、輕度認(rèn)知障礙(MCI)和AD患者的冰凍腦組織中純化的人腦源EV樣本,使用等壓多重串聯(lián)質(zhì)量標(biāo)簽(TMT)基于質(zhì)譜分析(MS)的蛋白定量方法。
然后,作者還使用加權(quán)相關(guān)網(wǎng)絡(luò)分析(WGCNA)來識別與特定細(xì)胞類型、生物途徑和疾病過程相關(guān)的共表達(dá)蛋白的重要模塊。本研究結(jié)果表明,細(xì)胞類型特異性EV在評估AD進展中具有重要作用,并為未來神經(jīng)退行性疾病的EV研究提供了一個框架。
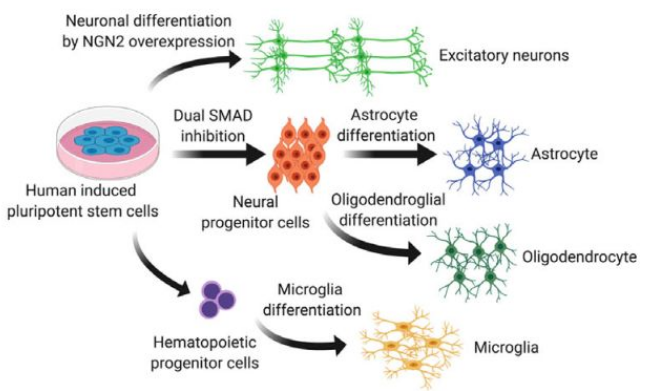
腦細(xì)胞類型分化與表征
總之,在本研究中作者結(jié)合從hipsC神經(jīng)細(xì)胞和AD腦源EV中分離的細(xì)胞類型特異性EV的蛋白質(zhì)組學(xué)研究,展示了細(xì)胞類型特異性EV標(biāo)記物用于EV分離的有效性和特異性,并為AD的EV蛋白質(zhì)組學(xué)網(wǎng)絡(luò)前景提供了新的展望。
作者強調(diào)了星形細(xì)胞來源的EV,特別是反應(yīng)性星形細(xì)胞在AD發(fā)病機制中的關(guān)鍵作用。重要的是,作者發(fā)現(xiàn)星形細(xì)胞來源的EV中的整合素β1(ITGB1)蛋白可能作為潛在的AD生物標(biāo)志物。這些發(fā)現(xiàn)提高了我們對神經(jīng)退行性疾病EV生物學(xué)的理解,并為開發(fā)專門針對AD的新的診斷和治療靶點提供了希望.
參考文獻(xiàn)
Yang You et al. Human neural cell type-specific extracellular vesicle proteome defines disease-related molecules associated with activated astrocytes in Alzheimer’s disease brain. J Extracell Vesicles. 2022 Jan;11(1):e12183. doi: 10.1002/jev2.12183.
相關(guān)新聞

