教您實驗原理及步驟 關于慢病毒感染細胞教程詳細講解
發布時間:
2021-12-13
來源:
作者:
閱讀數:
1. 實驗原理
慢病毒載體可以將外源基因或外源的shRNA有效地整合到宿主染色體上,從而達到持久性表達目的序列的效果。在感染能力方面可有效地感染神經元細胞、肝細胞、心肌細胞、腫瘤細胞、內皮細胞、干細胞等多種類型的細胞,從而達到良好的的基因治療效果。對于一些較難轉染的細胞,如原代細胞、干細胞、不分化的細胞等,使用慢病毒載體,能大大提高目的基因或目的shRNA的轉導效率,且目的基因或目的shRNA整合到宿主細胞基因組的幾率大大增加,能夠比較方便快捷地實現目的基因或目的shRNA的長期、穩定表達。
所以,在體外實驗及體內實驗的研究中,慢病毒己經成為表達外源基因或外源shRNA的常用載體形式之一,并且正在獲得越來越廣泛的應用。
2. 主要材料
細胞培養基、胰蛋白酶、胎牛血清、PBS、青霉素-鏈霉素溶液、慢病毒、Polybrene助轉染試劑
3. 主要試劑配制
(1)PBS磷酸鹽緩沖液:PBS粉劑每袋加ddH2O定容至1000mL,調pH7.2,121℃,30min,高壓滅菌,4℃保存備用。
(2)細胞生長培養液:臨用前根據需要在培養基中加入10%胎牛血清,再按1%體積分數加入雙抗貯存液(青霉素+鏈霉素),使青霉素和鏈霉素的終濃度分別為100 U/mL和100 ug/mL,置于4℃冰箱保存。
4. 實驗步驟
(1)胰酶消化細胞,無血清培養基重懸,調整細胞密度為0.5~1×105/ml(根據情況酌情調整),每孔200ul細胞懸液接種至24孔板,培養箱培養過夜。次日進行慢病毒感染,此時細胞的融合度約為70%左右。
(2)準備病毒:取出4℃保存的病毒,使用瞬時離心機離心20秒(使病毒完全懸于離心管底部即可);如果是凍存在-80℃的病毒需要先在冰上融化后使用。根據實驗按照MOI準確計算慢病毒用量,將其稀釋到培養基中,并盡可能保證所獲得的含有慢病毒的培養基的總體積為最小體積,以期獲得最佳的感染效率。
(3)根據預實驗確認MOI=100進行后續試驗,準確計算好每孔所需病毒原液量。慢病毒使用量=MOI*細胞數目/慢病毒滴度,吸取病毒液加入細胞中,同時加入5ug/mL的Polybrene助轉染試劑,以提高感染效率。
注:感染前細胞的狀態好壞對最終的感染效果高低影響很大,所以務必保證加病毒之前,細胞處于良好的生長狀態。
(4)混勻后將24孔板放在37℃度培養箱中孵育。
(5)8-12小時以后觀察細胞狀態。細胞狀態與未感染組無明顯差異,表明慢病毒對細胞沒有明顯毒性作用,繼續培養,24小時后更換為新鮮培養基。
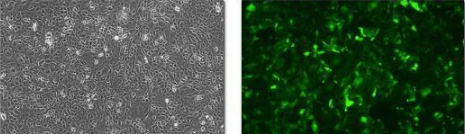
(6)感染48小時后,熒光顯微鏡觀察熒光表達情況,估計慢病毒感染目的細胞的效率。同時,收集樣本進行后續實驗檢測。
Lentivirus 表達時間較長,但在一般代謝較旺盛的細胞(如293T,BHK21等)上,病毒感染24h后可以觀察到GFP 熒光;代謝比較緩慢的細胞(如原代培養細胞,神經干細胞,胚胎干細胞等)GFP 蛋白表達時間較長,感染后72-96h甚至更長時間才可以觀察到GFP熒光。感染后的細胞可以連續培養一周,通過觀察GFP的表達時間和表達強度來確定Lentivirus 對目的細胞的感染情況。感染后期請根據細胞生長的情況對細胞進行及時換液和傳代,以保證細胞良好的生長狀態。
5. 實驗結果100X
相關新聞

