將基因編輯蛋白高效率遞送到動物模型細胞中 并顯示治療效果方法最新研究信息
發(fā)布時間:
2022-01-18
來源:
作者:
閱讀數(shù):
基因編輯方法有望治療一系列的疾病,但事實證明,將用于基因編輯的試劑安全有效地遞送到動物模型和人類細胞中充滿挑戰(zhàn)。如今,在一項新的研究中,來自美國布羅德研究所、加州大學歐文分校和賓夕法尼亞大學佩雷爾曼醫(yī)學院等研究機構(gòu)的研究人員開發(fā)出一種可以將基因編輯蛋白以足夠高的效率遞送到動物模型的細胞中并顯示治療效果的方法。相關(guān)研究結(jié)果于2022年1月11日在線發(fā)表在Cell期刊上,論文標題為“Engineered virus-like particles for efficient in vivo delivery of therapeutic proteins”。
在這項新的研究中,這些作者展示了他們?nèi)绾问褂酶脑斓牟《緲宇w粒(engineered virus-like particle, eVLP)來遞送堿基編輯器--在DNA中實現(xiàn)可編程的單堿基變化的蛋白---以及CRISPR-Cas9核酸酶,即一種在基因組中的目標位點切割DNA的蛋白。他們利用他們開發(fā)的eVLP讓小鼠體內(nèi)可能與高膽固醇水平有關(guān)的基因失效,并部分恢復了攜帶導致遺傳性失明的基因突變的小鼠的視覺功能。
科學家們長期以來一直在研究病毒樣顆粒(VLP)作為潛在的藥物遞送載體。VLP是由攜帶分子貨物的病毒蛋白組成的小型結(jié)構(gòu),但不包含病毒的遺傳物質(zhì),也不會引起感染。由于VLP缺乏病毒的遺傳物質(zhì),它們可能比其他使用實際病毒的遞送方法更安全,因為病毒可能將其遺傳物質(zhì)插入細胞的基因組中并可能導致癌癥。
這些作者確定了VLP的幾個限制其遞送效率的特性,并對這種顆粒的結(jié)構(gòu)進行了改造以克服這些瓶頸。他們說,由此產(chǎn)生的eVLP是首個向成年動物的多種組織遞送治療性基因編輯蛋白的VLP。
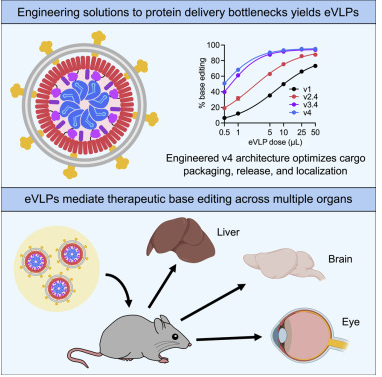
圖片來自Cell, 2022, doi:10.1016/j.cell.2021.12.021。
在這項新的研究中,當利用eVLP將基因編輯復合物作為蛋白遞送時,這些作者沒有檢測到任何脫靶編輯,但當基因編輯器作為DNA遞送時卻檢測到了。他們的觀察結(jié)果證實了之前的研究顯示使用蛋白形式的基因編輯試劑的好處,并表明eVLP可以安全地傳遞它們。他們補充說,他們開發(fā)的eVLP有可能不僅用于基因編輯,還可用于遞送其他的治療性蛋白。
論文通訊作者、布羅德研究所默金醫(yī)療改革技術(shù)研究所主任David Liu教授說,“盡管體內(nèi)遞送是一個反復出現(xiàn)的挑戰(zhàn),但是它是未來基因編輯發(fā)揮主要作用的一個至關(guān)重要的方面。”
Liu說,“VLP一直是最有吸引力的遞送技術(shù)之一,但一直受到體內(nèi)蛋白遞送效率低下的困擾。通過合理地開發(fā)分子解決方案來解決VLP遞送過程中的具體挑戰(zhàn),我們開發(fā)了eVLP,它可極大地增加了在體外培養(yǎng)的細胞中的遞送效力,同時也實現(xiàn)了在動物中的高效遞送。”
遞送瓶頸
幾十年來,VLP一直受到科學家們的關(guān)注,因為它的行為與病毒相似,可以進入細胞并遞送貨物,如治療性蛋白。人們可以通過使用VLP表面上的不同分子來影響它們在體內(nèi)的最終目的地,比如肝臟或神經(jīng)元。
為了利用這些特性并改遞送效率,Liu及其研究團隊系統(tǒng)性地改造了VLP架構(gòu)的不同部分,以優(yōu)化幾個關(guān)鍵步驟---VLP的產(chǎn)生,貨物如何被包裝到VLP中,以及貨物如何在細胞內(nèi)釋放和分布。
他們最終版本的eVLP包裝的貨物蛋白比他們以前設(shè)計的VLP多16倍,并且能夠?qū)⒓毎蛣游镏械木庉嬓侍岣吡?至26倍。正如他們所假設(shè)的那樣,他們幾乎沒有看到在不希望的位點進行編輯的證據(jù),也沒有看到病毒DNA被整入用eVLP處理的細胞的基因組中。
論文共同第一作者、Liu實驗室博士生Aditya Raguram說,“由于eVLP提供了強大的靶向編輯,并將非靶向編輯降至最低,我們希望它將作為一種更安全的方法,在體內(nèi)遞送基因編輯試劑。”
eVLP在起作用
這些作者使用他們優(yōu)化的eVLP系統(tǒng)來校正一系列小鼠和人類細胞中的突變,在某些情況下觀察到95%的編輯效率。
這些作者隨后使用eVLP將堿基編輯器遞送到小鼠的肝臟中,在那里他們有效地編輯了Pcsk9基因,其中這個基因一旦發(fā)生突變,就能大幅降低血液中的“壞”膽固醇水平,從而降低心臟病風險。他們發(fā)現(xiàn)單次注射經(jīng)編程后引發(fā)Pcsk9基因突變的eVLP就能使Pcsk9的平均編輯率達到63%,Pcsk9蛋白水平下降78%。他們說,他們預(yù)計這些結(jié)果將大大降低個人患冠心病的風險。
這些作者還利用單次注射eVLP來恢復攜帶失明突變的小鼠的視覺功能。他們校正了Rpe65基因的突變,所實現(xiàn)的編輯效率與其他堿基編輯遞送技術(shù)相當,但脫靶編輯和病毒DNA整合的風險較小。
這些作者還將eVLP直接注射到小鼠的大腦中,觀察到暴露在eVLP下的細胞可實現(xiàn)大約50%的編輯效率。未來的研究工作將集中在改善eVLP在整個大腦中的分布,但是這些結(jié)果表明有望向極其難以靶向的器官遞送基因編輯試劑。
論文共同第一作者、Liu實驗室博士后研究員Samagya Banskota說,“eVLP結(jié)合了病毒遞送系統(tǒng)和非病毒遞送系統(tǒng)的優(yōu)點。它也是可編程的,而且相對容易生產(chǎn),這使它成為有前途的蛋白遞送工具。我們期待著科學界采用我們的eVLP,并利用它改善對患者的治療性大分子遞送。”
Liu團隊如今正在擴大eVLP在動物體內(nèi)可以靶向的器官和細胞類型的范圍。他們還將繼續(xù)對eVLP進行表征,以更好地預(yù)測和減輕它們可能產(chǎn)生的任何不需要的免疫反應(yīng)。
Liu說,“鑒于我們知道了一些關(guān)鍵的eVLP瓶頸,以及我們?nèi)绾谓鉀Q這些瓶頸,即使我們不得不為不尋常的蛋白貨物開發(fā)新的eVLP,我們很可能可以做得更有效率。”他指出,他們的eVLP研究工作始于2018年初。
Liu說,“如今非常需要一種更好的方法,將蛋白遞送到動物和患者體內(nèi)的多種組織中。我們希望eVLP不僅可以用于遞送堿基編輯器,還可以用于遞送其他的治療相關(guān)蛋白。”
參考資料:
Samagya Banskota et al. Engineered virus-like particles for efficient in vivo delivery of therapeutic proteins. Cell, 2022, doi:10.1016/j.cell.2021.12.021.
相關(guān)新聞

